
Existujú rôzne typy chemických väzieb. Medzi nimi kovalentné, kovové, van der Waals, vodík a iónové. Poďme zistiť, aké sú iónové väzby a ich vlastnosti.

Atóm kovu ľahko odovzdá elektrón astane sa katiónom. Elektronegatívny atóm, ako je atóm halogénu, jednoducho odoberá elektrón a vytvára negatívne nabitý ión. Tieto nabité častice - anióny a katióny - tvoria ten, ktorý sa nazýva "iónová väzba". Príkladmi sú chlorid sodný, bromid draselný, jodid lítny a iné halogenidy kovov (väčšinou zásadité).
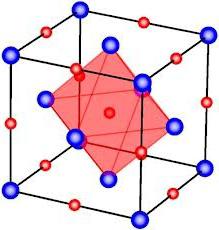
Nemá žiadne vlastnosti smernosti a sýtostiiónové viazanie. Príklady spojení s direktivitou a nasýtenosťou sú kovalentné donor-akceptorové väzby. Nenasýtená a nesmerová iónová sa prejavuje, pretože keď sú ióny pripojené k inému náboju, nedochádza k úplnej kompenzácii náboja. Môžu byť pripojené ďalšie protiľahlo nabité ióny a tak ďalej. Preto je umiestnený maximálny počet podobných okolo iónov, ale s iným označením. Toto číslo je však obmedzené kvôli vzájomnému odpudzovaniu rovnomerne nabitých iónov. Rovnováha sa dosahuje pri ich určitom vzájomnom usporiadaní, ktoré sa vyznačuje koordinačným číslom. Tento index závisí od pomeru polomerov iónov. Látky s iónovou väzbou majú často koordináciu kocky alebo oktaedru a sú kryštály.
Takže kryštál stolnej soli - chloridu sodného - má kubickú mriežku. V ňom sa každý chloridový ión viaže na šesť sodných iónov a každý ión sodíka so šiestimi chloridovými iónmi.

V oxidoch alkalických kovov a kovov alkalických zemínje tiež pozorovaná iónová väzba. Príkladmi takýchto zlúčenín sú oxid vápenatý, oxid sodný a ďalšie. Ióny môžu pozostávať nielen z jedného atómu, ale z niekoľkých. Vo vnútri takého komplexného iónu je iný a medzi samotnými iónmi je iónová väzba. Príklady: soli typu síranu draselného (v tomto prípade je draslík katión, síranový ión je anión).
Treba tiež poznamenať, že vlastnosti iónovlátky sa výrazne líšia svojimi vlastnosťami atómov a molekúl týchto látok. Napríklad chlórové ióny, ktoré sú súčasťou chloridu sodného, sú bezfarebné a bez zápachu a sú vhodné na výživu, zatiaľ čo molekulový chlór, zelenkastý plyn so štipľavým zápachom je jed. A atómov sodíka s vodou reaguje s výbuchom, zatiaľ čo ióny sa voľne rozpúšťajú.
</ p>