
Nie je to ani úloha na chemickej úrovniOrganizácia sveta hrá spôsob, ako spojiť štrukturálne častice, spojenia medzi sebou. Drvivý počet jednoduchých látok, menovite nekovových, má kovalentný nepolárny typ väzby, s výnimkou inertných plynov. Kovy v čistej forme majú špeciálny spôsob komunikácie, ktorý sa realizuje pomocou socializácie voľných elektrónov v kryštálovej mriežke.
Všetky komplexné látky (okrem niektorýchorganické) majú kovalentné polárne chemické väzby. Typy a príklady týchto zlúčenín budú uvedené nižšie. Medzitým je potrebné zistiť, ktorá vlastnosť atómu ovplyvňuje polarizáciu väzby.
Atómy, alebo skôr ich jadrá (ktoré, ako myvieme, že sú kladne nabité), majú schopnosť priťahovať a udržiavať hustotu elektrónov, najmä pri vytváraní chemickej väzby. Táto vlastnosť sa nazývala elektronegativita. V periodickej tabuľke sa jeho veľkosť zvyšuje v obdobiach a hlavných podskupinách prvkov. Hodnota elektronegativity nie je vždy konštantná a môže sa meniť napríklad so zmenou typu hybridizácie, do ktorej vstupujú atómové orbitaly.
Chemické väzby, typy a príklady, ktoré budúsú uvedené nižšie, alebo presnejšie, lokalizácia alebo čiastočný posun týchto väzieb na jedno z väzobných činidiel je presne vysvetlená elektronegatívnou charakteristikou prvku. Vytesnenie sa vyskytuje na atóme, v ktorom je silnejší.
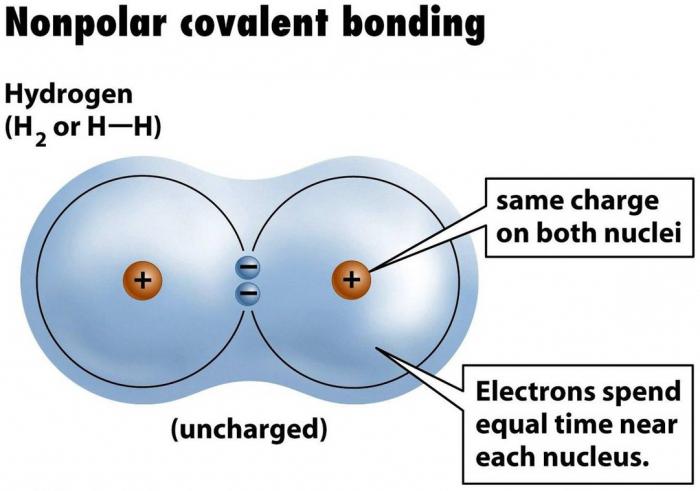
"Vzorec" kovalentnej nepolárnej väzby je jednoduchý -dva atómy rovnakej povahy spájajú elektróny svojich valenčných škrupín s párom spojov. Takýto pár sa nazýva rozdelený, pretože patrí rovnomerne obom stranám väzby. Je to preto, že hustota elektrónov v socializácii pár elektrónov, atómy pohybujú v stabilnom stave, pretože kompletná ich vonkajšie elektrónové úrovni, a "oktet" (alebo "dublet" v prípade vodíka, jednoduchá látka H2, on má jednu s-orbitu, dokončiťktorý potrebuje dva elektróny) je stav vonkajšej úrovne, na ktorú sa všetky atómy snažia, pretože jeho plnenie zodpovedá stavu s minimálnou energiou.

Príklad nepolárnej kovalentnej väzby je vanorganické a akokoľvek podivné, ale aj v organickej chémii. Tento typ spojenia je spoločné pre všetky jednoduché látok - nekovov okrem vzácnych plynov, ako úroveň väzbe inertného atómu plynu a už dokončil oktet elektrónov, a preto sa s podobnou väzobnou samotný nemá žiadny význam pre neho, a dokonca aj menej energeticky priaznivé. V organike sa nevyskytuje nepolarita v jednotlivých molekulách určitej štruktúry a má konvenčnú povahu.
Príklad nepolárnej kovalentnej väzbyobmedzený na niekoľko molekúl jednoduché látky, zatiaľ čo dipólov zlúčeniny, v ktorých je hustota elektrónov je čiastočne posunutá smerom k viac elektronegativní prvok, - drvivej väčšine. Akákoľvek kombinácia atómov s rôznou elektrónovou aktivitou dáva polárne spojenie. Väzby v organických látkach sú najmä kovalentné polárne väzby. Niekedy sú iónové, anorganické oxidy tiež polárne a v soli a kyseline prevažuje iónový typ väzby.
Ako extrémny prípad polárneho viazania niekedyzvážte iónový typ zlúčenín. Ak je elektronegatívnosť jedného z prvkov podstatne vyššia ako druhá, elektrónový pár sa úplne posunie z centra komunikácie k nej. Takto sú ióny rozdelené. Ten, kto vezme elektronický pár, zmení sa na anión a dostane záporný náboj a stratový elektrón sa zmení na katión a stáva sa pozitívnym.

Látky s kovalentnou nepolárnou väzbou sú,Napríklad všetky binárne molekuly plyn: vodík (H - H), kyslíka (= O), dusík (vo svojej molekule 2 atómy spojené trojitú väzbu (N ≡ n)); kvapaliny a pevné látky: chlór (Cl - Cl), fluór (F - F), bróm (Br - Br), jódu (I - I). A tiež komplexné látky pozostávajúce z atómov rôznych prvkov, ale so skutočnou zhodnou hodnotou elektronegatívnosti, napríklad hydridom fosforu - PH3.
Je mimoriadne jasné, že všetky organické látkyzložitá. Vzniká otázka, ako môže byť nepolárna väzba v komplexnej látke? Odpoveď je celkom jednoduchá, ak si myslíte trochu logicky. Ak sa hodnoty elektronegativity viazaných prvkov nepatrne líšia a nevytvárajú dipólový moment v zlúčenine, takáto spojitosť môže byť považovaná za nepolárnu. Práve táto situácia sa týka uhlíka a vodíka: všetky väzby C-H v organickej látke sa považujú za nepolárne.
Príkladom nepolárnej kovalentnej väzby je molekulametán, najjednoduchšia organická zlúčenina. Pozostáva z jedného atómu uhlíka, ktorý je podľa svojej valencie viazaný jednoduchými väzbami na štyri atómy vodíka. V skutočnosti molekula nie je dipól, pretože v ňom nie je lokalizácia nábojov, nejakým spôsobom a kvôli tetraedrálnej štruktúre. Hustota elektrónov je rovnomerne rozložená.

Príklad nepolárnej kovalentnej väzby je tiež vzložitejších organických zlúčenín. Realizuje sa z dôvodu mezomerových účinkov, to znamená postupného ťahania hustoty elektrónov, ktorá rýchlo zomrie pozdĺž uhlíkového reťazca. V molekule hexachlóretánu je teda väzba C-C nepolárna v dôsledku jednotného odťahovania elektrónovej hustoty šiestimi atómami chlóru.
Okrem kovalentnej väzby, ktorá mimochodom môžektoré sa majú uskutočňovať aj na donor-akceptorovom mechanizme, existujú iónové, kovové a vodíkové väzby. Krátke charakteristiky predposledných dvoch sú uvedené vyššie.

Vodíková väzba je intermolekulárnaelektrostatickú interakciu, ktorá sa pozoruje, ak má molekula atóm vodíka a akýkoľvek iný, ktorý má nepárové páry elektrónov. Tento druh spojenia je oveľa slabšie ako ostatné, ale vzhľadom k tomu, že látka z týchto väzieb je možné vytvoriť veľmi významne prispieva k vlastnostiam zlúčeniny.
</ p>